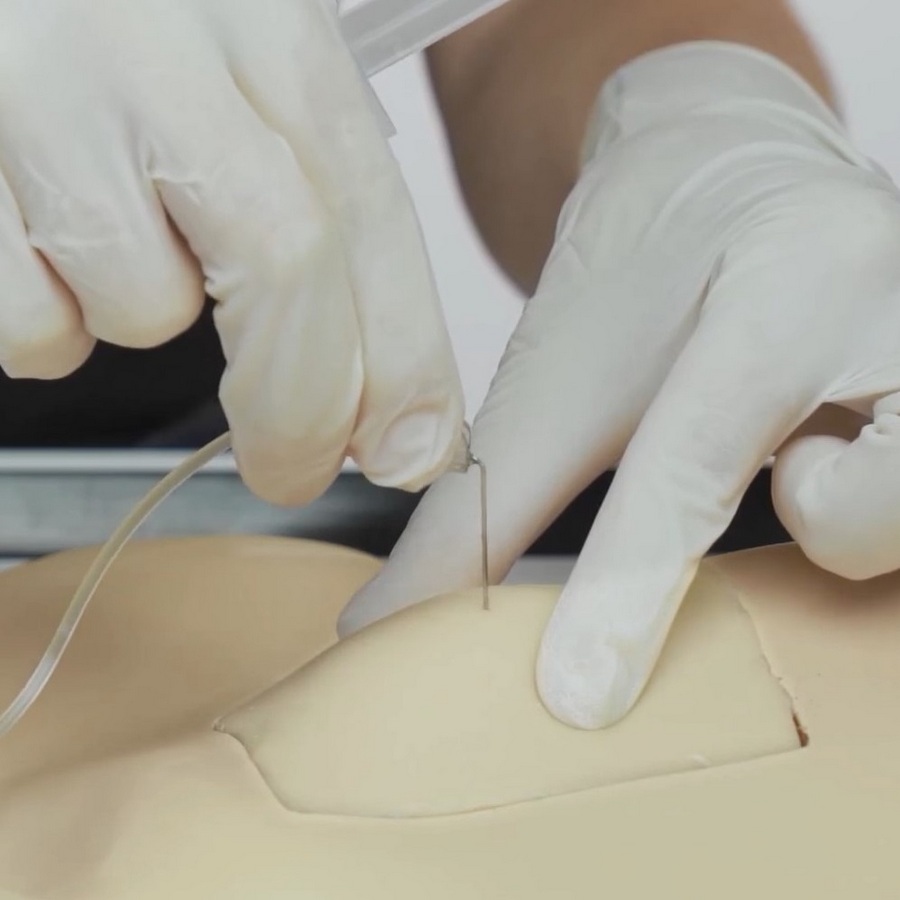
Opieka nad „portem” w domu pacjenta | Film instruktażowy
Zapraszamy do zapoznania się z nagraniem, w którym zaprezentowany został prawidłowy sposób opieki nad \"portem\". W materiale zostało pokazane: przygotowanie do podania czynnika, przygotowanie czynnika i odpowiedniego sprzętu, jak odpowiednio przygotować osobę, której będzie podany czynnik, w jaki sposób prawidłowo podać czynnik za pośrednictwem \"portu\", jak zakończyć zabieg i zabezpieczyć miejsce wkłucia, jakie są możliwe powikłania związane z używaniem portu dożylnego. https://vimeo.com/985547326 Materiał powstał na zlecenie firmy Takeda.

Autoiniekcje dożylne | Film instruktażowy
Zapraszamy do zapoznania się z nagraniem, w którym zaprezentowany został prawidłowy sposób przeprowadzania autoiniekcji. W materiale zostało zaprezentowane: w jaki sposób przygotowania do przeprowadzenia autoiniekcji, w jaki sposób przygotowania leku oraz niezbędnego sprzętu, jakie są zalecane miejsca do dożylnych iniekcji, jakich miejsc należy unikać, co świadczy o prawidłowym wykonaniu iniekcji, w jaki sposób uwidocznić żyłę, jak przeprowadzić autoiniekcję do żyły zgięcia łokciowego oraz autoiniekcję do żyły dłoni. https://vimeo.com/983026185 Materiał powstał na zlecenie firmy Takeda.
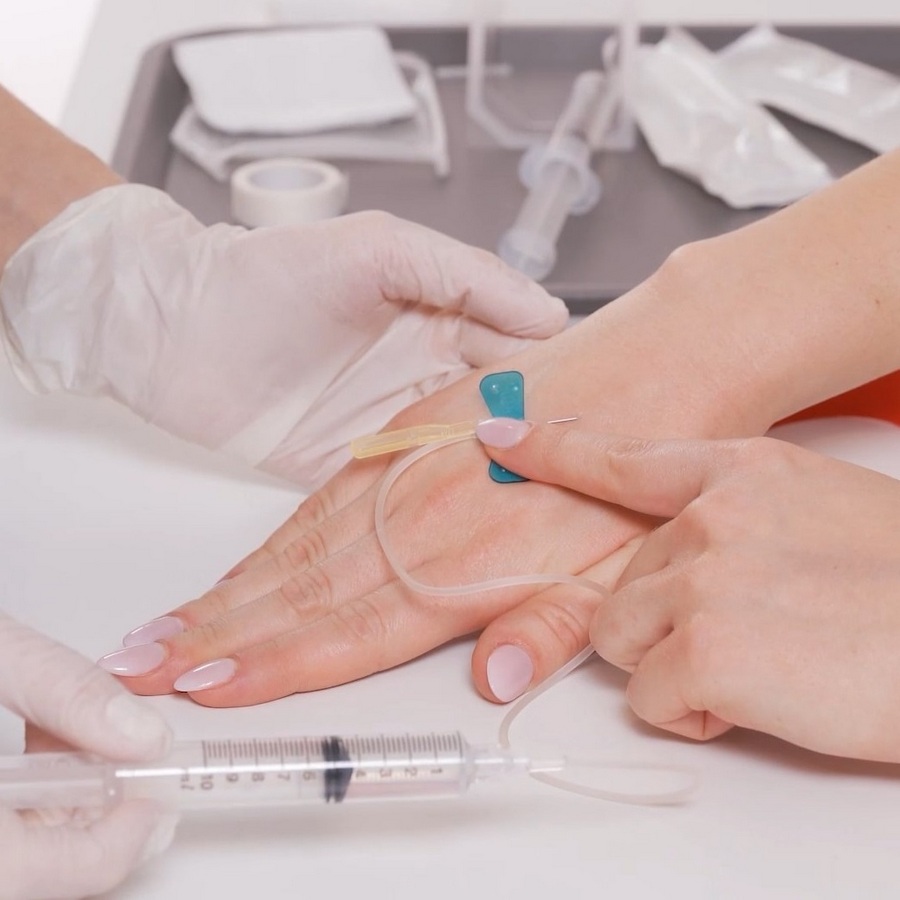
Iniekcje dożylne | Film instruktażowy
Zapraszamy do zapoznania się z nagraniem, w którym zaprezentowany został prawidłowy sposób przeprowadzania iniekcji. W nagraniu wyjaśnione zostały następujące elementy: sposób przygotowania do przeprowadzenia iniekcji, sposób przygotowania leku i niezbędnego sprzętu, zalecane miejsca do dożylnych iniekcji, jakich miejsc należy unikać, co świadczy o prawidłowym wykonaniu iniekcji, sposoby na uwidocznienie żyły, jak wygląda iniekcja do żyły dłoni oraz żyły zgięcia łokciowego. https://vimeo.com/983026076 Zapraszamy do zapoznania się z materiałem. Materiał powstał na zlecenie firmy Takeda.

„Każdy z nas ma swoją własną hemofilię” – Adam Trojańczyk
“Sądzę, że każdy z nas ma swoją własną „hemofilię” w życiu – trudność, która wydaje się nie do pokonania. Sposób, w jaki poradzimy sobie z tym wyzwaniem będzie określał dokąd ostatecznie dojdziemy w życiu” – Adam Trojańczyk. „Życie jest jak pudełko czekoladek – nigdy nie wiesz, co Ci się trafi” to słowa wypowiadane przez Foresta Gumpa, bohatera książki Winstona Grooma, które weszły do kanonu bon mot dzięki ekranizacji powieści i genialnej roli Toma Hanksa. Są one symbolem zmagań osób na co dzień borykających się z wszelkimi chorobami. Niekiedy niektórzy z nas dostają od życia coś czego nie planowali, np. chorobę przewlekłą. Życie wtedy staje się nie lada wyzwaniem. Jednak, mimo wielu trudności i obciążeń jakie niesie ze sobą choroba, można realizować swoje cele i nie rezygnować z marzeń. Przydaje się do tego siła charakteru, determinacja i bardzo ważny element życia – wsparcie najbliższych. Forest Gump, dotknięty autyzmem, biegł przez Stany, by ukoić ból spowodowany odrzuceniem miłosnym. Terry Fox, 22-letni Kanadyjczyk, który mógłby być pierwowzorem bohatera książki i filmu biegł po amputacji prawej nogi, by zwiększyć świadomość Kanadyjczyków na temat chorób nowotworowych. Adam Trojańczyk ćwiczy, strzela i dzieli się swoimi doświadczeniami życia z hemofilią typu B. Historia Adama Trojańczyka, 39 latka, który od urodzenia stawia czoła hemofilii jest opowieścią o człowieku, który mimo wielu trudności i przeciwności losu zdecydował, że chce walczyć o siebie i swoją pogodną przyszłość. Gdy po latach okazało się, że osiągnął swój szeroko rozumiany sukces, jego wrażliwość pchnęła go o krok dalej. Postanowił, że przełamie jeszcze jedno swoje ograniczenie – poczucie wstydu i skrępowania i zacznie dzielić się swoją historią z innymi. Jego celem jest zarażanie ludzi optymizmem. Obecnie jest odnoszącym sukcesy CEO, ale przede wszystkim stał się rzecznikiem osób, które zmagają się z chorobami przewlekłymi. Mamy nadzieję, że historia Adama będzie dla was inspiracją i pozwoli wam budować waszą historię, która być może pewnego dnia stanie się ważna dla kogoś innego. Choroba Osoba, która od urodzenia żyje z ostrą formą hemofilii typu B jest mocno doświadczona, zahartowana i wytrenowana do stawiania czoła wszelkim przeciwnościom losu. Trudności związane z chorobą, częstymi hospitalizacjami, rozłąkami z rodzicami, bólem wynikającym z nieustannych zabiegów medycznych, wkłuć, pobierania krwi w tak młodym wieku mogłyby sugerować, że jedyne na co może sobie pozwolić osoba z hemofilią to niezbędny sen i odpoczynek, aby zebrać siły na kolejny dzień walki. Historia Adama pokazuje nam wszystkim, że tak nie jest i zachęca innych, by brali z niego przykład. Adam jest mężczyzną, mężem i ojcem, ambitnym, pełnym pasji, niezmiernie wrażliwym, osiągającym sukcesy zawodowe, sumiennym, bardzo pracowitym i wysportowanym. Życie Adama od samego początku było zagrożone z uwagi na możliwość wystąpienia trudnych do opanowania krwawień wewnętrznych. „Pierwsze krwawienie wystąpiło u mnie, zaraz po moich pierwszych urodzinach. Gdy byłem dzieckiem, rodzice stale walczyli o moje zdrowie, a nasze życie było przerywane częstymi wizytami w szpitalu. Było ich tak wiele, że gdy teraz o nich myślę, to zlewają mi się w pamięci w jeden ciągły pobyt szpitalny.” W wyniku krwawień w jego nogach wystąpiły zatory, które doprowadziły do całkowitego zaniku mięśni, atrofii, a ból towarzyszył mu praktycznie w każdej minucie życia. Nawet w tak trudnej chwili, Adam nie poddał się i wykazał się ogromną siłą charakteru. Za wszelką cenę chciał powrócić do formy, odzyskać sprawność w nogach i ponownie normalnie funkcjonować. „Zdeterminowany, aby poprawić moją kondycję fizyczną, rozpocząłem przygodę z treningami sportowymi. Na początku mojej drogi, przez pierwszych kilka lat, pojawiałem się na siłowni pięć razy w tygodniu”. Dzięki ćwiczeniom wykorzystującym masę ciała osoby trenującej, kalistenice oraz taśmie TRX Adam wrócił do pełni sił. W ciągu ośmiu lat wykonał około 3000 sesji treningowych, dzięki czemu udało mu się pozbyć większości przykurczy w stawach, przestał kuleć i zauważył znaczące zmiany w swoim ogólnym funkcjonowaniu. Rodzice Gdy na chorobę przewlekłą choruje dziecko to tak naprawdę choruje cała rodzina. Każdy przeżywa tę sytuację w inny sposób. Inaczej interpretuje ją i przeżywa chore dziecko, rodzeństwo, rodzice czy dziadkowie. To przede wszystkim rodzice chorych dzieci stawiani są przed ogromnym wyzwaniem, zarówno fizycznym jak i psychicznym. Świadomość, że ukochane dziecko od początku życia będzie borykać się z trudnościami i bólem jest bardzo wyczerpująca. Ale równie wyczerpujące jest żonglowanie domem, pracą, szpitalem, snem, własnymi pasjami i czasem wolnym. Trudno jest to wytłumaczyć osobom, które nie doświadczyły momentu przyjmowania informacji o diagnozie swojego dziecka. Rodzice dzieci przewlekle chorych są cichymi bohaterami, nad którymi powinno się roztaczać szczególną opiekę. Zasługują na szacunek, podziw, pomoc i wyrozumiałość. „W wyniku masywnego krwawienia do kolana przestałem chodzić. Przez kilka miesięcy leżałem w szpitalu oddalonym o setki kilometrów od naszego domu rodzinnego. Mój tata odwiedzał mnie codziennie. Przyjeżdżał pociągiem po pracy, by spędzić ze mną trochę czasu. Do domu wracał późno w nocy, chwilę drzemał i o 4 nad ranem wstawał, by znowu zdążyć do pracy. Imponował mi swoją postawą i determinacją, a także nauczył jaką dużą wartość ma miłość zbudowana na zaangażowaniu i poświęceniu dla drugiej osoby. To dzięki tacie, sam stałem się oddanym ojcem dla moich dzieci”. Przekuwanie przeciwności losu w sukces Arystoteles pisał, że ten kto nie czerpie przyjemności z tego co robi i nie odnosi sukcesów, nie może być szczęśliwy. Idąc tym tropem można wnioskować, że każdy kto zajmie się tym co naprawdę sprawia mu przyjemność powinien odnosić sukcesy, być szczęśliwym i dzięki temu obdarowywać szczęściem osoby wokół siebie. Adam z pewnością udowadnia, że jeśli działamy w obszarze, który nas interesuje, w pełni mu się poświęcamy i konsekwentnie dążymy do celu to mimo przeciwności losu nasze działanie doprowadzi nas do sukcesu i szczęścia. „Jako nastolatek interesowałem się wieloma rzeczami. Nocami pisałem wiersze, które były czytane w nocnych programach lokalnej rozgłośni radiowej. W ciągu dnia tworzyłem programy komputerowe. Pierwszy napisałem w wieku 11 lat na Commodore 64. Bardzo polubiłem także matematykę i fizykę, i godzinami rozwiązywałem równania, albo pisałem oprogramowania, które rozwiązywały je za mnie. Moje zamiłowanie do komputerów zaprowadziło mnie na Politechnikę, gdzie studiowałem na Wydziale Fizyki Technicznej, Informatyki i Matematyki Stosowanej. Napędzany nieprzemijającą potrzebą rozwoju bardzo szybko otworzyłem swoją firmę, mimo że byłem totalnie bez grosza. W ten oto sposób od 2004 roku jestem powiązany z branżą IT”. Adam jako młody nastolatek, z uwagi na konieczność oszczędzania się, zmuszony był do przejścia w tryb edukacji domowej. Nie stracił jednak pozytywnego nastawienia do życia. Przez chwilę doświadczał izolacji i osamotnienia, czuł się nieobecny i obciążony, ale jak mówi w wywiadzie przeprowadzonym przez EHC – „Moje doświadczenie związane z chorobą i cierpieniem stało się katalizatorem zmian, zmusiło mnie do jeszcze większej dyscypliny, sumienności i zaprowadzenia porządku w moim życiu. Te wartości przyświecają mi w życiu i pomagają nie ustawać w działaniu, mimo trudności, które napotykam. Moja determinacja sprawia, że nigdy się nie poddaję”. Obecnie jest dyrektorem generalnym w firmie tworzącej oprogramowanie. Jego działania na rzecz osób chorujących na hemofilię sprawiły, że w 2019 roku został wybrany na członka głównego Zarządu Polskiego Stowarzyszenia Chorych na Hemofilię, a w 2023 roku został Prezesem Koła PSCH w Łodzi. Doświadczenie choroby, ból i cierpienie, postawa i opieka rodziców ukształtowały jego silny charakter. – „Nauczyłem się jak prowadzić firmę, dokładnie w ten sam sposób, w jaki nauczyłem się samodzielnie wstrzykiwać lek. Zacząłem od początku i wyciągałem wnioski z popełnianych błędów”. Wartości, którymi kieruje się w życiu, takie jak potrzeba samorozwoju, zmieniania świata na lepsze i altruizm, ukształtowały człowieka sukcesu, jakim niewątpliwie jest Adam Trojańczyk. To co wyróżnia Adama spośród większości ludzi to ogromna szczerość i otwartość w sposobie mówienia o chorobie. Adam bez wahania przyznaje jak trudno było mu otworzyć się i z odwagą, i z godnością opowiadać o swojej niełatwej historii z chorobą w tle. Adam podkreśla, że do działania i jeszcze większego zaangażowania w sprawy chorych na hemofilię motywuje go żona oraz wiadomości spływające od osób, z którymi spotyka się podczas prelekcji, spotkań na uniwersytetach czy tych organizowanych w miastach przy okazji dni świadomości hemofilii. Bardzo istotnym przekazem Adama, zwłaszcza do młodych osób jest zwrócenie uwagi na fakt, iż: “W czasach mediów społecznościowych obserwujemy zniekształconą rzeczywistość pokazującą same dobre momenty życia, pięknych, zdrowych ludzi i natychmiastowe wyniki działań. Za mało mówimy o wyzwaniach życia codziennego i motywacji niezbędnej do naszego rozwoju. Zdałem sobie sprawę, że wyjście z cienia i mówienie otwarcie o swoich trudnościach i problemach może być ratunkiem dla kogoś w potrzebie i inspiracją do zmiany życia na lepsze”. Źródło: ehc.eu

Mam hemofilię i niedługo kończę 18 lat | Gdy dziecko z hemofilią osiąga pełnoletność
Osiągnięcie pełnoletności przez osobę z hemofilią to moment przełomowy w życiu młodego człowieka i jego rodziny. Wiąże się z szeregiem zmian wynikających ze specyfiki podziału systemu zdrowia na leczenie dzieci oraz osób dorosłych. Kończąc 18 lat pacjent wychodzi ze struktur pediatrycznych i trafia w gąszcz zawiłego systemu leczenia dorosłych. Osoba zmagająca się ze skazą krwotoczną może od tego momentu chcieć samodzielne podejmować decyzje dotyczące swojego zdrowia fizycznego i psychicznego, pogłębiać wiedzę na temat choroby i próbować nowych sposobów leczenia. Jednakże może się okazać, że pełnoletnie dziecko w ogóle nie będzie skłonne do przejęcia odpowiedzialności za chorobę i aktywności z nią związanych, a status quo, w którym to rodzice kontrolują chorobę i planują leczenie, bardzo mu odpowiada. Dla całej rodziny może to być wyzwanie, do którego warto przygotowywać się z wyprzedzeniem. Przejście z pediatrycznej ochrony zdrowia do ochrony zdrowia dla dorosłych Jako że szpitale pediatryczne obejmują opieką tylko osoby poniżej 18. roku życia, wraz z osiągnięciem dojrzałości metrykalnej wiąże się także zmiana szpitala z dziecięcego na szpital dla dorosłych oraz wybór lekarza hematologa dla dorosłych. Bardzo ważne jest, by chorzy utrzymywali stały kontakt z lekarzami dotychczas prowadzącymi ich proces leczenia oraz z Ośrodkiem Leczenia Hemofilii najbliższym ich miejscu zamieszkania. Powinni przekazać całą dokumentację medyczną i wgląd w używane przez nich aplikacje mobilne kontrolujące stan zdrowia pacjenta nowemu lekarzowi. Podstawowym elementem różnicującym opiekę pediatryczną i opiekę zdrowotną osób dorosłych jest wiek pacjenta. Pediatria zajmuje się profilaktyką i leczeniem dzieci i młodzieży od urodzenia do 18. roku życia. Po osiągnięciu pełnoletności, każdy pacjent podlega opiece lekarza internisty lub lekarza POZ, a pacjent z hemofilią – dodatkowo pozostaje pod opieką hematologa. Przejście z pediatrycznej ochrony zdrowia do ochrony zdrowia dla dorosłych może na początku powodować zakłopotanie i wydawać się trudne z uwagi na zmianę prowadzącego lekarza hematologa dotychczas dostępnego niemalże całą dobę. Poradnie hematologiczne dla dorosłych niestety nie funkcjonują na tych samych zasadach co pediatryczne i jest to nowość dla pacjenta i jego rodziny przyzwyczajonej do innych standardów leczenia. Istnieją jednak sprawdzone sposoby na zmniejszenie poziomu stresu, jednym z nich jest zdobywanie i gromadzenie informacji, a także planowanie etapów leczenia z wyprzedzeniem. Pełnoletnie dziecko, które wkracza w system leczenia w szpitalach dla dorosłych ma prawo, by na początku, podczas wizyt medycznych także towarzyszyła mu dorosła osoba sprawująca nad nim opiekę lub upoważniona do jej sprawowania. Obecność bliskiej osoby dorosłej może być dużym wsparciem dla młodego pacjenta lub pacjentki, dla których zapamiętanie szeregu wiadomości medycznych, zadawanie pytań i ogólne orientowanie się w rzeczywistości szpitalnej może stanowić niepotrzebny czynnik stresujący i wyzwanie, zwłaszcza na początku nowej drogi w pełnoletności. Młody, ale pełnoletni pacjent powinien być informowany, że przysługuje mu prawo do poszanowania prywatności i że może poprosić o rozmowę sam na sam z lekarzem prowadzącym, bez obecności osób trzecich. W miarę zdobywania doświadczenia i wiedzy na temat swojej choroby, pełnoletni pacjent stanie się osobą, z którą lekarz będzie przeprowadzał wywiad i od której będzie uzyskiwał wszystkie niezbędne wiadomości na temat stanu zdrowia. Choroba wymaga świadomości i akceptacji, ale równie ważnym jej aspektem jest dyscyplina. Mnogość tematów, o których należy pamiętać sprawia, że nawet doświadczona osoba może czasem czuć się zagubiona i może potrzebować wsparcia innych osób. Poniżej znajdują się najważniejsze kwestie, o których należy pamiętać będąc pacjentem służby zdrowia. Wybór lekarza POZ Proces planowania leczenia należy rozpocząć od umówienia wizyty lekarskiej z odpowiednim wyprzedzeniem. Niektóre wizyty u specjalistów wymagają skierowania wystawionego przez lekarza prowadzącego, do którego obowiązuje rejestracja w placówce POZ. Każdy polski obywatel jest przypisany przez NFZ do placówki medycznej świadczącej usługi opieki zdrowotnej. Na stronie Ministerstwa Zdrowia i Narodowego Funduszu Zdrowia znajdują się szczegółowe wytyczne dotyczące wyboru lekarza rodzinnego. W ciągu roku kalendarzowego każdy może bezpłatnie dokonać dwóch zmian lekarza POZ. W przypadku osób chorujących na skazę krwotoczną, oprócz do lekarza POZ, są obowiązkowo przypisani do lekarza hematologa prowadzącego leczenie związane stricte z hemofilią. Wizyta lekarska Wizyty medyczne z wielu powodów kojarzą się z pośpiechem, natłokiem informacji i stresem. Szczególnie na początku ścieżki leczenia tuż po wizycie, pacjentowi może towarzyszyć poczucie, że wiele spraw nie zostało odpowiednio omówionych w gabinecie. Aby zwiększyć jej efektywność, dobrym pomysłem jest wykonywanie sumiennego planu działania. Przed wizytą u lekarza pierwszego kontaktu dobrze jest się zastanowić, jakie kwestie do poruszenia z lekarzem są aktualnie istotne i spisać je w formie listy tematów do poruszenia na kartce lub w notatce w telefonie. Wszystkie nurtujące pytania także powinny znaleźć się na takiej liście, aby po wyjściu z gabinetu nie pozostać z poczuciem, że kluczowe sprawy nie zostały omówione. Z uwagi na wydłużony czas oczekiwania na wizyty u specjalistów w systemie polskiej opieki zdrowotnej bardzo istotne jest odpowiedzialne traktowanie umówionych terminów, punktualne stawianie się w gabinetach, a także odwoływanie wizyt w razie niemożliwości przybycia. Należy pamiętać o konieczności posiadania dowodu potwierdzającego tożsamość i znajomości numeru PESEL. Na wizyty u specjalistów dobrze jest przychodzić z dotychczas zgromadzoną dokumentacją medyczną, jeśli pacjent taką posiada, i informować o fakcie chorowania na hemofilię. Wizyta u lekarza hematologa wymaga przedstawienia skierowania wystawionego przez lekarza POZ. Ubezpieczenie zdrowotne Pacjenci małoletni i uczący się objęci są pakietem ubezpieczeniowym swoich rodziców lub opiekunów prawnych. Powinni jednak pamiętać, że w momencie usamodzielnienia się i podjęcia pracy muszą zadbać o odpowiedni pakiet ubezpieczeniowy. Oprócz obowiązkowego ubezpieczenia zdrowotnego, każdy może wykupić dodatkowe pakiety ubezpieczeń prywatnych. Dlaczego warto planować proces leczenia i czy powinno się to robić wspólnie z rodziną? Procesowi planowania leczenia powinny towarzyszyć spokój, skupienie i rozmowa, czyli ważne elementy zwiększające poczucie komfortu wszystkich osób w niego zaangażowanych. Stan równowagi psychicznej i fizycznej jest kolejnym niezbędnym elementem procesu leczenia i dążenia do zdrowia. Każda dorosła osoba powinna samodzielnie podjąć decyzję, czy chce włączyć w proces leczenia osoby trzecie, czy potrzebuje wsparcia i czy jest gotowa je przyjąć. W przypadku dzieci, warto ustalić, który moment życia dziecka będzie najbardziej odpowiedni do podjęcia próby samodzielnego kontrolowania choroby i przejmowania obowiązków z nią związanych w kontekście aspektów fizycznych, takich jak podawanie leków, wykonywanie wlewów lub zastrzyków. Jeśli chodzi o opiekę psychiczną i kontaktowanie się z psychologiem lub psychoterapeutą, to według prawa polskiego, pacjent musi mieć ukończone 18 lat lub uzyskać zgodzę formalną od opiekuna sprawującego władzę rodzicielską. Zanim pacjent osiągnie pełnoletniość i przejmie odpowiedzialność za swoją chorobę, to na rodzicach spoczywa obowiązek sprawowania kontroli nad procesem leczenia i jego planowanie. Stopniowe i uważne oddawanie odpowiedzialności za proces leczenia choroby przewlekłej osobie nieletniej, to bardzo ważny etap w życiu rodziny. Im wcześniej dziecko zaczyna być uświadamiane o chorobie i angażowane w proces leczenia, tym łatwiej będzie mu odnaleźć się z chorobą w dorosłości. Każdy rodzic lub opiekun, znając swoje dziecko, podejmuje decyzję o tym, czy dziecko może już wziąć na swoje barki ciężar związany ze świadomością towarzyszącej mu choroby przewlekłej. Bardzo dużą rolę w procesie oswajania z chorobą odgrywa lekarz hematolog, który może zwracać się podczas wizyt bezpośrednio do dziecka, a nie tylko do rodziców czy opiekunów. Aktywne uczestnictwo podczas spotkań medycznych może sprawić, że dziecko nabierze pewności siebie, będzie zainteresowane pogłębianiem wiedzy o chorobie i będzie chciało wziąć odpowiedzialność za swoje leczenie. W momencie usamodzielnienia się, osoba z hemofilią, oprócz oczywistych obowiązków każdej osoby dorosłej, takich jak znalezienie pracy, mieszkania czy kupna samochodu, musi uwzględnić szereg kwestii wynikających z choroby. Należy pamiętać o tym, by: Z odpowiednim wyprzedzeniem zadbać o ciągłość leczenia, które zostaje przerwane w momencie osiągnięcia pełnoletniości przez pacjenta. Czas oczekiwania na lekarza hematologa zajmującego się hemofilią dorosłych może wynieść nawet 2 lata1; Znać dokładną nazwę swojej jednostki chorobowej; Znać nazwę i dawkowanie czynnika krzepnięcia; Pamiętać o zamawianiu czynnika krzepnięcia, leków i innych akcesoriów w odpowiednim ośrodku; Znać sposoby i wytyczne przechowywania leków; Wiedzieć, czy i kiedy występuje konieczność podania czynnika; Wiedzieć w jaki sposób zrobić infuzję; Prowadzić historię krwawień w książeczce lub aplikacji; Znać historię swojego leczenia, uczuleń na leki etc.; Zgromadzić najważniejsze informacje na temat ośrodka znajdującego się najbliżej miejsca zamieszkania, zanotować ważne numery telefonów i nazwiska lekarzy do kontaktu w razie konieczności; Poinformować zaprzyjaźnione osoby o chorobie i zapoznać je z możliwymi scenariuszami działania w razie konieczności niesienia pomocy; Wiedzieć co zrobić w sytuacji krwawienia lub urazu i poinstruować o tym osoby zaufane; Zabezpieczyć czynnik w miejscu pracy i nauki oraz poinstruować innych jak go użyć w sytuacji zagrożenia zdrowia. Dziecko przewlekle chore staje się niezależne. Jak oddać kontrolę nad jego zdrowiem? Dla niektórych rodziców lub opiekunów usamodzielnianie się dziecka chorującego przewlekle może stanowić wyzwanie, do którego muszą się dobrze i mądrze przygotować. Niekiedy, może to także wymagać przepracowania z osobami do tego wykwalifikowanymi. Poczucie lęku, niepokoju, frustracji, a czasem złości na sytuację, na dziecko lub na system to naturalne reakcje kochającego rodzica i opiekuna. Dobrym pomysłem na zminimalizowanie negatywnych uczuć i emocji może być po prostu szczera rozmowa z dzieckiem, w trakcie której rodzic podzieli się swoimi wątpliwościami i lękami związanymi z oddaniem dziecku odpowiedzialności za kontrolowanie choroby i towarzyszącymi jej obowiązkami. Warto pamiętać także, że rodzic ma prawo przeżywać trudne emocje, a ich obecność nie oznacza słabości i braku panowania nad sytuacją. Wręcz przeciwnie – są one przejawem troski i miłości wobec dorastającego dziecka. Usamodzielnienie się i niezależność Gdy chory jest gotowy przejąć na siebie czynności związane z podawaniem leków, zyskuje niezależność od szpitala i lekarzy, ale także przejmuje kontrolę nad swoim życiem oraz znacząco podnosi jakość funkcjonowania na co dzień, w szkole, pracy, a także podczas podróży. Oszczędza czas i może uniknąć bólu towarzyszącego wykonywaniu infuzji przez inne osoby. Dzięki dorastaniu z chorobą, pacjent ma możliwość uczenia się jej na bieżąco i radzenia sobie z jej objawami stopniowo się do nich przyzwyczajając. Nauka samodzielnego wykonywania zabiegów to dobry początek większej niezależności i dbania o własne zdrowie. Pacjenci oraz ich rodzice mogą poprosić o pomoc w rozpoczęciu nauki samodzielnego wykonywania wlewów. Osoba chorująca na hemofilię, która planuje wyprowadzenie się z domu rodzinnego powinna przemyśleć możliwe scenariusze, w których będzie musiała samodzielnie decydować o krokach prowadzących do podjęcia leczenia. Kalendarze, przypomnienia i aplikacje Istnieje wiele sposobów, które pomagają stać się bardziej zorganizowanym i niezależnym. Jeśli trudno jest pamiętać o wszystkich ważnych kwestiach związanych z kontrolą choroby, dobrym pomysłem może być korzystanie z kalendarza. Czy będzie to wersja mobilna dostępna w telefonie lub komputerze, czy klastyczny papierowy notes zależy wyłącznie od preferencji i wygody osoby z nich korzystającej. Kalendarz telefoniczny umożliwia ustawienie powtarzających się przypomnień, a także udostępnianie ich bliskim. Urządzenie mobilne daje dodatkowo możliwość korzystania ze specjalnych aplikacji, które pozwalają monitorować zapasy czynnika, rejestrować wykonane zabiegi i krwawienia. Mogą one być również pomocne w przygotowaniu planu leczenia. Lek. med. Irena Woźnica-Karczmarz Kierownik Działu Krwiolecznictwa, Kierownik Banku Hematopoetycznych Komórek Progenitorowych oraz Kierownik Regionalnego Ośrodka Leczenia Hemofilii i Pokrewnych Skaz Krwotocznych dla Dzieci Uniwersytecki Szpital Dziecięcy w Lublinie, pisze: „Obecnie trwają prace nad wprowadzeniem w ramach programu e-hemofilia dzienniczków elektronicznych w formie aplikacji na telefon dla wszystkich pacjentów ze skazami krwotocznymi. Realny termin ich wprowadzenia to zapewne rok 2025. Pacjenci zostaną zobligowani do stosowania tych aplikacji. Dostawy czynników krzepnięcia do domu pacjenta do profilaktyki i wydania do leczenia krwawień znajdą się pod szczególnym nadzorem. A pacjenci będą musieli raportować zużycie leków do profilaktyki, a w przypadku krwawień dodatkowo wpisywać informację o krwawieniu. Prawdopodobnie będzie można ustawić w aplikacji powiadomienia o terminach planowanych podań leków.” Papierowy notes lub kalendarz będzie idealny dla osób, które lubią same tworzyć notatki, używać kolorowych pisaków i naklejek. Odnalezienie najbardziej optymalnego systemu spośród dostępnych na rynku może być czasochłonne, ale z pewnością będzie pomocne w zarządzaniu chorobą. Warto szukać informacji na forach poświęconych chorobie, w grupach zrzeszających osoby chorujące na hemofilię, rozmawiać z rodzicami i przyjaciółmi i bez skrępowania zadawać pytania dotyczące najbardziej nurtujących kwestii. Źródła: DiMichele d. et al. Mental Health and Hemophilia in Adolescence and Young Adulthood. Bloom Stream Media, March 2022.Firoozi M. Cognitive, Emotional, and Behavioral Problems of Children with Hemophilia. Iranian Journal of Blood & Cancer. 2017; 9(3): 69-74.https://hemophilianewstoday.com/living-with-hemophilia/https://kidshealth.org/en/teens/diseases-conditions/https://kidshealth.org/en/parents/hemophilia.htmlhttps://www.factoredin.org.au/
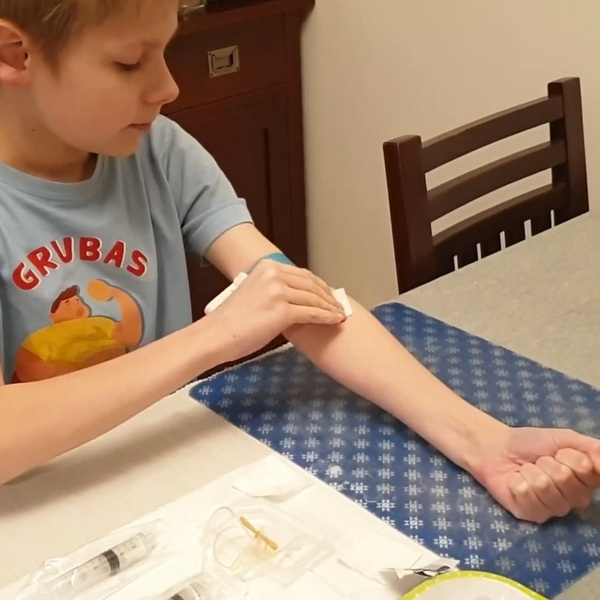
Jak Gucio radzi sobie z podawaniem czynnika krzepnięcia krwi
Zapraszamy do zapoznania się z filmami, w których zaprezentowane zostały przyjazne metody podawania czynnika krzepnięcia u małych dzieci oraz autoiniekcją u starszych dzieci.Bohaterem filmów jest Gucio oraz jego historia podawania czynnika krzepnięcia na przestrzeni kilku lat. https://www.youtube.com/watch?v=ZsHweS0TKOM https://youtu.be/NQe3vtR5zDY?feature=shared Zapraszamy do zapoznania się z materiałami.

Życzenia świąteczne
Szanowni Państwo, z okazji zbliżających się Świąt Wielkanocnych życzymy radości, życzliwości i nadziei. Niech ten czas przyniesie wytchnienie od codziennych trudów i problemów oraz będzie wyjątkową okazją do spotkania w gronie najbliższych.

Życzenia świąteczne
Z okazji zbliżających się Świąt Bożego Narodzenia pragniemy złożyć Państwu serdeczne życzenia zdrowia i radości. Niech ten szczególny czas będzie wypełniony nadzieją i wsparciem najbliższych oraz da wytchnienie od codziennych obowiązków i zmartwień, a Nowy Rok 2024 niech przyniesie wszelką pomyślność. Wszystkiego, co najlepsze!
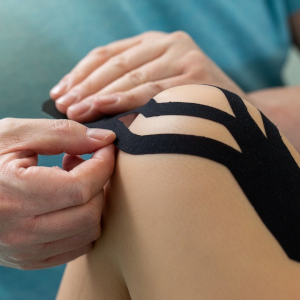
Kinesiotaping w hemofilii – czy to naprawdę może pomóc?
Czy kiedykolwiek zdarzyło się, że skręciłeś kostkę lub uderzyłeś się w kolano, co sprawiło, że przez kilka dni utykałeś, musiałeś korzystać z ortezy, kul, a nawet wózka inwalidzkiego? A może był to przytrzaśnięty palec, skręcony łokieć czy krwawienie z nadgarstka, które sprawiły, że nie mogłeś używać ręki, przez co proste czynności, takie jak golenie, wydawało się tak trudne? Pytanie, co zrobisz, gdy do takiej sytuacji dojdzie. Będziesz odpoczywać czy się ruszać? Dr Michael Zolotnisky, znany też jako HemoDoc, dorastał z ciężką hemofilią i wielokrotnie, z powodu krwawienia w udach, nie mógł chodzić. Starał się uważać na siebie podczas gry w koszykówkę, by uniknąć kolejnego urazu palca, co uniemożliwiłoby mu swobodne poruszanie ręką przez wiele dni. Sam zauważa, że jako młody człowiek nie był pewien, jak, poza leczeniem profilaktycznym, radzić sobie z uporczywymi krwawieniami. Gdy ukończył studia doktoranckie na kierunku fizjoterapia, jego misją stało się edukowanie społeczności osób cierpiących na zaburzenia krzepnięcia krwi. Na początku dr Michael Zolotinsky skupił się na fizjoterapii wodnej, alternatywnych metodach leczenia bólu, a także bezpiecznych sposobów na uprawianie sportu i bezpieczne wykonywanie ćwiczeń. Następnie odkrył taśmę terapeutyczną, znaną również jako taśma kinezjologiczna, taśma Kinesio, taśma K-Active czy KT. Jest to elastyczny bawełniany pasek z klejem akrylowym, który może być stosowany w leczeniu bólu i niepełnosprawności spowodowanych urazami sportowymi lub innymi zaburzeniami fizycznymi. Korzystanie z niej pomaga w kontrolowaniu bólu i wspieraniu słabych mięśni. Dr Zolotinsky rozpoczął przeprowadzanie prezentacji, podczas których uczył osoby z zaburzeniami krwawienia, jak prawidłowo korzystać z taśmy Kinesio. Jakie były rezultaty? Osoby mające problemy ze stawami odczuły ulgę w bólu i mogły poruszać się szybciej i wygodniej. Taśma Kinesio zapewnia wsparcie ortezy, ale jest elastyczna, aby zapobiegać ograniczonemu zakresowi ruchu i niwelować przykurcze mięśni. Może również ułatwić pracę słabszym mięśniom lub hamować ich napinanie. Jedna z najskuteczniejszych technik tapingu pomaga zmniejszyć obrzęk poprzez odprowadzenie płynu limfatycznego lub mazi stawowej. Warto pamiętać, że bez odpowiednich instrukcji stosowanie taśmy Kinesio może spowodować więcej szkód niż korzyści. Dla osób, które nie mają możliwości, by spotkać się z dr. Michaelem Zolotniskym osobiście, pomocny może stać się jego kanał na YouTube - HemoDoc. Zamieszczając instrukcje, dr Zolotnisky dąży to tego, by każda osoba mogła żyć pełnią życia i nie pozwalała, aby stan zdrowia ograniczał jej możliwości. Dr Zolotnisky zwraca także uwagę, że każdy jest inny i trudno jest znaleźć rozwiązanie pasujące dla każdego. Dobrze jest najpierw skonsultować się z lekarzem lub ośrodkiem leczenia hemofilii i zapytać o zastosowanie taśmy Kinesio w indywidualnym przypadku, a następnie obejrzeć filmy instruktażowe dla uzyskania wskazówek, jak skutecznie zastosować taśmę Kinesio dla złagodzenia bólu stawów. Na podstawie: https://www.biomatrixsprx.com/news/the-benefits-of-kinesio-taping-ask-the-hemodoc
Leczenie chorych z hemofilią niepowikłaną i powikłaną inhibitorem do czynnika krzepnięcia – zasady leczenia, dawkowanie czynników krzepnięcia, zasady wywoływania tolerancji immunologicznej (ITI), leczenie pacjentów w przypadku nieskutecznej ITI – część 3
W Polsce zespół ekspertów opracował wytyczne postępowania w hemofilii A i B powikłanej i niepowikłanej inhibitorem, które zostały zaktualizowane w 2016 i 2017 roku. Zalecenia dotyczą diagnostyki i leczenia skaz krwotocznych, postępowania z nosicielkami hemofilii, zasad wykonywania badań prenatalnych, strategii postępowania z chorymi na hemofilię. Leczenie chorych z hemofilią powikłaną inhibitorem jest zupełnie inne niż pacjentów bez inhibitora i o tym należy pamiętać. Jeśli u chorego pojawi się inhibitor do czynnika krzepnięcia, wówczas leczenie substytucyjne brakującym czynnikiem krzepnięcia będzie już nieskuteczne. Niezwykle istotne jest wykonywanie regularnie badań na obecność inhibitora do czynnika krzepnięcia przez pacjentów leczonych substytucyjnie, w szczególności chorujących na ciężką postać hemofilii. Co ważne, ryzyko powstania inhibitora jest najwyższe w ciągu 50 pierwszych dni ekspozycji na czynnik krzepnięcia, czyli u najmłodszych chorych, ale wzrasta także u osób starszych. Długość życia chorych na hemofilię wydłuża się dzięki stosowaniu skutecznego leczenia, a starszy wiek predysponuje do chorób cywilizacyjnych, nowotworów i chorzy poszukują pomocy specjalistów. Ośrodki Leczenia Hemofilii, które powstały, powinny nie tylko prowadzić leczenie skaz krwotocznych, ale też umożliwić chorym dostęp do różnych specjalistów. Nadrzędnym celem w postępowaniu z chorym na ciężką hemofilię powinno być efektywne zapobieganie samoistnym krwawieniom do stawów i mięśni oraz krwawieniom zagrażającym życiu, w tym krwawieniom śródczaszkowym, krwawieniom w okresie okołooperacyjnym, a także skuteczne leczenie ostrych epizodów krwawień. Podawanie czynników krzepnięcia w celu zapobiegania krwawieniom określa się mianem profilaktyki, a leczenie epizodów krwawień to leczenie na żądanie (on demand). Podstawą nowoczesnego leczenia hemofilii jest długoterminowa profilaktyka krwawień, rozpoczęta w pierwszych latach życia. W Polsce w 2008 roku wdrożony został program lekowy finansowany przez NFZ o nazwie: „Zapobieganie krwawieniom u dzieci z hemofilią A i B”. Do programu mogły być włączone, za zgodą rodziców, wszystkie dzieci z ciężką postacią hemofilii A i B od urodzenia do ukończenia 18. roku życia, a także dzieci z hemofilią umiarkowaną, jeśli występowały u nich krwawienia dostawowe. Standardowo do programu włączane były dzieci pomiędzy 1. a 2. rokiem życia, u których nie było jeszcze krwawień (lub było jedno krwawienie do stawu), a stosowana profilaktyka nosiła nazwę profilaktyki pierwotnej. Jeśli u pacjentów były wcześniej co najmniej dwa krwawienia do stawów, to włączani byli do profilaktyki wtórnej. Do profilaktyki pierwotnej i wtórnej początkowo stosowano jedynie osoczopochodne czynniki krzepnięcia, z czasem dla nowo włączanych do profilaktyki pacjentów dostępne już były rekombinowane czynniki krzepnięcia. Dawkowanie czynnika krzepnięcia do profilaktyki było stałe, pacjenci mogli otrzymywać w hemofilii A czynnik VIII maksymalnie 3 razy w tygodniu w dawkach od 25 do 40 j./kg. Tak prowadzona profilaktyka nie zawsze była skuteczna. U dzieci zdarzały się krwawienia dostawowe, najczęściej po urazach i konieczne było dodatkowo leczenie krwawień. W ostatnich latach zaszły spore zmiany w programie lekowym, bardzo korzystne dla pacjentów. U dzieci wprowadzono profilaktykę spersonalizowaną opartą o wyniki badań farmakokinetycznych dla stosowanych leków i zależną od potrzeb pacjenta. Pacjenci mogą otrzymywać profilaktycznie czynniki krzepnięcia co drugi dzień, a jeśli jest taka potrzeba, to nawet codziennie, stosowane dawki leków też mogą być zmienne. Spersonalizowana profilaktyka dostosowana do potrzeb chorych, ich aktywności i potrzeb spowodowała zmniejszenie ilości krwawień i polepszenie stanu stawów. Należy jednak pamiętać, że nawet najlepiej ustawione leczenie może być nieskuteczne, jeśli chory nie będzie przestrzegał zaleceń lekarskich. W przypadku dzieci i młodzieży bardzo ważne jest, żeby czynniki krzepnięcia podawać w godzinach rannych, aby wykorzystać ich potencjał. Niestety dość często z powodu braku czasu rodzice podają dzieciom lek po południu lub wieczorem, co powoduje, że maksymalne stężenie leku osiągane jest w godzinach nocnych, kiedy dziecko jest nieaktywne. Koncepcja długoterminowej profilaktyki dostosowanej do indywidualnych parametrów farmakokinetycznych i indywidualnych potrzeb pacjenta służy realizacji najbardziej ambitnego celu w terapii substytucyjnej hemofilii, czyli całkowitego wyeliminowania samoistnych krwawień przy równoczesnej optymalizacji zużycia koncentratów i minimalizowaniu częstości wstrzyknięć dożylnych. Miernikiem skuteczności długoterminowej profilaktyki jest brak krwawień i brak zmian zwyrodnieniowych w stawach ocenianych zarówno w badaniu fizykalnym (wg skali HJHS), jak również za pomocą technik obrazowych. Inny rodzaj profilaktyki to profilaktyka trzeciorzędowa. Polega ona na profilaktycznym podawaniu czynników krzepnięcia regularnie i długoterminowo u chorych, którzy mają udokumentowane zmiany zwyrodnieniowe w stawach. Z kolei profilaktyka okresowa polega na podawaniu czynnika krzepnięcia w celach profilaktycznych przez czas krótszy niż 45 tygodni w roku. Poniżej znajduje się 16 wytycznych długoterminowej profilaktyki krwawień opracowanych przez zespół polskich ekspertów, które są niezwykle ważne i w całości chciałabym je przedstawić. U każdego pacjenta z ciężką hemofilią A lub B należy dążyć do zastosowania pierwotnej profilaktyki krwawień. U każdego pacjenta z ciężką hemofilią A lub B, u którego nie zastosowano pierwotnej profilaktyki krwawień, należy dążyć do zastosowania profilaktyki wtórnej. U każdego chorego na ciężką hemofilię A lub B z artropatią hemofilową, należy rozważyć zastosowanie trzeciorzędowej profilaktyki krwawień. U części pacjentów objętych długoterminową profilaktyką krwawień, u których nie występują żadne samoistne krwawienia i których fenotyp krwotoczny określa się jako łagodny, można rozważyć zakończenie regularnego wstrzykiwania koncentratu niedoborowego czynnika krzepnięcia z chwilą osiągnięcia dojrzałości fizycznej. U pacjentów takich należy stosować okresową profilaktykę krwawień w sytuacjach zwiększonej aktywności fizycznej, kiedy ryzyko wystąpienia krwawień zwiększa się. Jeśli po zakończeniu długoterminowej profilaktyki zaczynają pojawiać się krwawienia do stawów lub o innym umiejscowieniu, należy powrócić do regularnego wstrzykiwania koncentratu niedoborowego czynnika krzepnięcia. Powrót do długoterminowej profilaktyki jest szczególnie wskazany, gdy krwawienia uniemożliwiają kontynuowanie edukacji lub podjęcie pracy zawodowej. Dane z piśmiennictwa nie pozwalają na określenie optymalnych dawek FVIII i FIX w ramach długoterminowej profilaktyki. Za najbardziej właściwe uważa się: w hemofilii A: podawanie FVIII w dawce 25-50 IU/kg 3 razy w tygodniu lub co drugi dzień, w hemofilii B: podawanie FIX w dawce 25-50 IU/kg 2 razy w tygodniu (ze względu na różnice właściwości farmakokinetycznych pdFIX i rFIX, dawki rFIX mogą być większe niż pdFIX), u części pacjentów dobry efekt kliniczny osiąga się po zastosowaniu mniejszych dawek i/lub wydłużając odstępy między iniekcjami. Jednakże część pacjentów będzie wymagała większych dawek lub ich częstszego podawania. Koncentrat niedoborowego czynnika krzepnięcia powinien być podawany rano, a nie wieczorem przed snem (szczyt aktywności czynnika krzepnięcia powinien przypadać w ciągu dnia). Jeśli w trakcie stosowania długoterminowej profilaktyki pojawiają się krwawienia, należy rozważyć zmianę schematu profilaktyki (np. zmniejszenie odstępów między wstrzyknięciami albo zastosowanie dodatkowych wstrzyknięć, np. przed okresami zwiększonej aktywności fizycznej). Krwawienia występujące w okresie profilaktyki leczy się w taki sam sposób, jak krwawienia u pacjentów nieobjętych profilaktyką. Częste krwawienia w trakcie długoterminowej profilaktyki świadczą o braku skuteczności zastosowanej formy terapii i są wskazaniem do modyfikacji schematu profilaktycznego. Dodatkowo, należy w takiej sytuacji upewnić się, że nie doszło do pojawienia się inhibitora do niedoborowego czynnika krzepnięcia. Za najbardziej właściwą formę długoterminowej profilaktyki uważa się profilaktykę dostosowaną do indywidualnych potrzeb pacjenta, które wynikają z właściwości farmakokinetycznych niedoborowego czynnika krzepnięcia oraz wieku, dostępu do żył, trybu życia i aktywności fizycznej danego pacjenta. Sposób prowadzenia długoterminowej profilaktyki może ulegać modyfikacjom w przypadku zmian ww. parametrów. Decyzję o rozpoczęciu pierwotnej lub wtórnej profilaktyki, wyborze dawki czynnika VIII lub IX, założeniu cewnika do centralnej żyły podejmuje doświadczony klinicysta z ośrodka leczenia hemofilii. W czasie stosowania pierwotnej i wtórnej profilaktyki pacjenci powinni być poddawani regularnym (nie rzadziej niż co 6-12 miesięcy) badaniom w ośrodkach leczenia hemofilii w celu oceny skuteczności i bezpieczeństwa stosowanego leczenia: oceniać stan narządu ruchu badaniem fizykalnym; zaleca się stosowanie skali HJHS, notować wszystkie epizody krwawień w trakcie stosowania profilaktyki oraz analizować ich potencjalne przyczyny, tak aby modyfikując schemat profilaktyki, można było skuteczniej im zapobiegać, oceniać stosowanie się pacjenta (rodziców pacjenta) do wymogów schematu profilaktyki; nieprzestrzeganie zasad profilaktyki może być przyczyną jej nieskuteczności, okresowo oceniać najniższą aktywność niedoborowego czynnika krzepnięcia w osoczu pacjenta poddawanego długoterminowej profilaktyce; występowanie krwawień i stwierdzenie aktywności niedoborowego czynnika krzepnięcia poniżej <1% jest wskazaniem do modyfikacji programu profilaktyki, rozważyć okresową ocenę stanu narządu ruchu metodami radiologicznymi (MRI w celu poszukiwania niewielkich zmian zwyrodnieniowych); RTG u pacjentów z jawną klinicznie artropatią. Nowoczesne leczenie hemofilii, niezależnie od tego, czy polega na profilaktyce, czy na stosowaniu koncentratów w trybie „na żądanie”, opiera się na terapii domowej. Początkowo rodzice, a następnie sami pacjenci powinni nabyć umiejętności wykonywania dożylnych wstrzyknięć koncentratów czynników krzepnięcia. W przypadku często nawracających krwawień do określonego stawu lub mięśnia u pacjenta z hemofilią A lub B nieobjętego pierwotną, wtórną ani trzeciorzędową profilaktyką należy zastosować przez kilka tygodni lub miesięcy regularne wstrzyknięcia FVIII lub FIX w celu zahamowania krwawień. W okresie krótkoterminowej profilaktyki należy stosować fizjoterapię, która przyspiesza powrót do zdrowia. Dodatkowo należy poinstruować pacjenta, że optymalnym postępowaniem może być rozpoczęcie długoterminowej profilaktyki krwawień. U każdego pacjenta z ciężką hemofilią A lub B, który przebył krwawienie zagrażające życiu (np. do centralnego układu nerwowego), należy rozważyć bezterminową profilaktykę z zastosowaniem koncentratu FVIII lub FIX. Z chwilą wprowadzenia do lecznictwa w Polsce koncentratów czynników krzepnięcia o przedłużonym działaniu, Grupa ds. Hemostazy ogłosi swoje stanowisko w sprawie ich wykorzystania w długoterminowej profilaktyce krwawień u chorych na hemofilię A i B. Leczenie krwawień w hemofilii u chorych może wymagać hospitalizacji. Krwawienia do mięśni i stawów można z powodzeniem leczyć w domu, o ile nie towarzyszy im silny ból. Krwawienia zagrażające życiu muszą być leczone w warunkach szpitalnych. Dawkowanie czynnika VIII lub IX w leczeniu różnych krwawień jest różne. Należy pamiętać, że koncentraty czynników krzepnięcia powinny być wstrzyknięte jak najszybciej po wystąpieniu krwawienia. Pacjent z krwawieniem niepoddającym się leczeniu w warunkach domowych, krwawieniem zagrażającym życiu lub wiążącym się z silnym bólem lub urazem, o dużym nasileniu, a zwłaszcza zlokalizowanym w obrębie głowy, szyi, klatki piersiowej i jamy brzusznej musi być hospitalizowany. Leczenie substytucyjne ciężkich krwawień należy monitorować, oznaczając aktywność niedoborowego czynnika krzepnięcia, a w przypadku słabej reakcji na leczenie konieczne jest wykonanie badania w kierunku inhibitora do czynnika VIII lub IX. U pacjentów ze skazami krwotocznymi zaleca się unikanie zastrzyków domięśniowych oraz leków upośledzających hemostazę, w tym leków antyagregacyjnych i przeciwkrzepliwych. W przypadku ostrego krwawienia do stawów i mięśni za wyjątkiem mięśnia biodrowo-lędźwiowego zalecana aktywność czynnika krzepnięcia powinna wynosić 40-60%. W hemofilii A należy podać czynnik VIII w dawce 20-30 j./kg, w hemofilii B czynnik IX w dawce 60-60 j./kg. Jeśli krwawienie nie ustępuje po 12-24 godzinach (z reguły po 1-2 dawkach koncentratu), pacjent powinien zostać zbadany przez lekarza. W przypadku krwawienia do stawu od lat obowiązuje zasada R.I.C.E (Rest, czyli odpoczynek; Ice, czyli lód; Compression, czyli ucisk; Elevation, czyli uniesienie kończyny). W ostatnim czasie zaczęto jednak podważać zasadność stosowania lodu, ponieważ obniżanie temperatury ciała negatywnie wpływa na proces krzepnięcia krwi i może nasilić krwawienie. Przeciwbólowo można stosować COX-2 inhibitory, paracetamol, a w szczególnych przypadkach leki narkotyczne (lek z wyboru to tramadol). Fizjoterapia powinna być wdrożona z chwilą ustępowania bólu i obrzęku. Jeśli krwawienie nie ustępuje w ciągu 48-72 godzin i towarzyszy mu utrzymujący się ból i obrzęk, wówczas można rozważyć aspirację krwi ze stawu pod osłoną leczenia substytucyjnego. Po aspiracji staw musi być całkowicie unieruchomiony, a aktywność czynnika VIII i IX utrzymywana na poziomie 40-60% przez kolejne 2-3 doby. W każdym przypadku krwawienia do stawu niereagującego na leczenie substytucyjne konieczne jest wykonanie badania na obecność inhibitora. Krwawienia do mięśni mogą być bardzo groźne, krwiaki uciskające na naczynia i nerwy mogą spowodować trwałe uszkodzenia. Krwawienie do mięśnia biodrowo-lędźwiowego może dawać takie same objawy, jak zapalenie wyrostka robaczkowego. Leczenie jest zasadniczo różne, krwawienie do mięśnia leczy się zachowawczo, a zapalenie wyrostka robaczkowego wymaga interwencji chirurgicznej. W leczeniu substytucyjnym krwawienia do mięśnia biodrowo-lędźwiowego stosuje się czynniki krzepnięcia przez wiele dni oraz leki przeciwbólowe, należy odciążać bolący mięsień, stosując odpowiednie ułożenie kończyny, a po ustąpieniu objawów natychmiast rozpocząć rehabilitację. W przypadku podejrzenia krwawienia do centralnego układu nerwowego obowiązuje zasada – najpierw lecz, potem diagnozuj. Urazy głowy należy leczyć substytucyjnie, tak samo intensywnie, jak wylewy krwi do CUN, chyba, że badania obrazowe (tomografia komputerowa, rezonans magnetyczny) wykluczą obecność ostrego krwawienia do mózgu lub rdzenia kręgowego. Konieczne jest uzupełnienie niedoborowego czynnika krzepnięcia jak najszybciej do 100% (czynnik VIII – 50 j./kg; czynnik IX – 100 j./kg). Każdy pacjent z podejrzeniem krwawienia do CUN musi być leczony w warunkach szpitalnych. Pierwszym objawem krwawienia do CUN u chorych z hemofilią są silne bóle głowy. U każdego chorego po przebytym krwawieniu do CUN musi być rozważona bezterminowa wtórna profilaktyka krwawień. Krwawienie do szyi i gardła jest stanem zagrożenia życia z uwagi na ryzyko niedrożności dróg oddechowych. Konieczne jest jak najszybsze wstrzyknięcie czynnika krzepnięcia. Niedoborowy czynnik krzepnięcia należy uzupełnić do 100% normy. Leczenie musi być prowadzone w warunkach szpitalnych, niekiedy w oddziale intensywnej opieki medycznej. Ostry krwotok z górnego odcinka przewodu pokarmowego wymaga leczenia w warunkach szpitalnych i substytucji czynnikiem krzepnięcia. Konieczne może być badanie endoskopowe, aby sprawdzić przyczynę krwawienia i zamknąć krwawiące naczynie. Krwawienie z przewodu pokarmowego powinno być, oprócz substytucji czynnikiem krzepnięcia, leczone lekami hamującymi fibrynolizę (kwas traneksamowy). Krwawienie do gałki ocznej wymaga natychmiastowego podania czynnika krzepnięcia, hospitalizacji i pilnej konsultacji okulistycznej, aby uzyskać opinię o właściwym sposobie dalszego postępowania. W przypadku krwiomoczu, jeśli nie towarzyszy mu ból, postępowanie ogranicza się do leżenia w łóżku i intensywnego nawadniania przez 48 godzin. Jeśli krwiomocz jest bardzo intensywny lub towarzyszy mu ból, konieczne jest rozpoczęcie leczenia substytucyjnego. Jeśli krwiomocz nawraca lub stale występuje krwinkomocz, konieczna jest konsultacja urologa i/lub nefrologa. Krwawienia z błony śluzowej jamy ustnej i krwawienia z nosa można opanować, stosując jedynie leki antyfibrynolityczne (kwas traneksamowy). W przypadku krwawienia z jamy ustnej, lek antyfibrynolityczny może być stosowany miejscowo w postaci roztworu do płukania. Jeśli takie postępowanie nie jest wystarczające, wówczas konieczne jest podanie czynnika krzepnięcia. W krwawieniach z nosa często miejscowo stosuje się spongostan nasączony trombiną oraz ucisk przewodu nosowego. Jeśli krwawienia nawracają, konieczna jest konsultacja laryngologa lub stomatologa. Niewielkie rany i otarcia nie wymagają leczenia substytucyjnego. Ranę należy odkazić i zabezpieczyć plastrem z jałowym opatrunkiem. Tylko głębokie rany wymagają leczenia substytucyjnego. Złamania kości zawsze wymagają leczenia szpitalnego. Pierwszą czynnością jest podanie niedoborowego czynnika krzepnięcia. Wybór dalszego leczenia należy do ortopedy, który zadecyduje o leczeniu operacyjnym lub zachowawczym. Należy unikać długotrwałego unieruchomienia i jak najszybciej rozpoczynać fizjoterapię. Ciąża i poród u kobiety nosicielki hemofilii wymaga nadzoru nie tylko ginekologa, ale też hematologa i genetyka. W czasie ciąży u kobiet nosicielek hemofilii A bardzo rzadko dochodzi do krwawień, ponieważ w okresie ciąży aktywność czynnika VIII wzrasta. Poród powinien się odbywać w ośrodku, który ma dostęp do laboratorium oznaczającego czynniki krzepnięcia oraz do czynników krzepnięcia. W okresie porodu i połogu aktywność czynnika krzepnięcia VIII i IX powinna być utrzymywana powyżej 50%. Sposób porodu powinien być ustalony w oparciu o czynniki położnicze i hematologiczne. W trakcie porodu nie wolno stosować kleszczy ani próżnociągu, ponieważ zwiększa to ryzyko urazu dziecka. Zaleca się, aby badanie aktywności czynników krzepnięcia wykonać z krwi pępowinowej, a każdy noworodek płci męskiej z podejrzeniem lub rozpoznaną hemofilią powinien mieć wykonane przezciemiączkowe USG przed wypisem do domu. W razie stwierdzenia krwawienia, powinien być natychmiast leczony rekombinowanym czynnikiem VIII lub IX. Zabiegi operacyjne u chorych na hemofilię powinny być wykonywane w specjalistycznych centrach leczenia hemofilii, które mają dostęp do odpowiednich koncentratów czynników krzepnięcia i odpowiedniej bazy diagnostycznej. Stosowanie leczenia substytucyjnego w okresie okołooperacyjnym wymaga oznaczania aktywności niedoborowych czynników krzepnięcia w celu stosowania właściwych dawek leków. W przypadku dużych zabiegów operacyjnych i w stanach zagrażających życiu, można stosować koncentraty czynników krzepnięcia w ciągłym wlewie. Pojawienie się inhibitorów, czyli przeciwciał skierowanych do czynników krzepnięcia jest obecnie najpoważniejszym powikłaniem hemofilii. Jeśli inhibitor pojawi się, to leczenie substytucyjne staje się nieskuteczne. Profilaktyka i leczenie chorych z inhibitorami polega na stosowaniu czynników omijających, których koszty są ogromne, a skuteczność mniejsza niż czynników krzepnięcia u chorych bez inhibitorów. Inhibitor do czynnika VIII pojawia się u około 30% chorych na ciężką postać hemofilii A i u około 3-13% pacjentów z hemofilią A umiarkowaną i łagodną. W hemofilii B inhibitor pojawia się średnio u około 3% chorych. Do powstania inhibitora predysponują: wczesne leczenie dużymi dawkami czynnika krzepnięcia, wylewy i zabiegi operacyjne wymagające intensywnego leczenia substytucyjnego, rodzaj mutacji genu, inhibitor w rodzinie. Do powstania inhibitora najczęściej dochodzi w ciągu pierwszych 50 dni ekspozycji na czynnik krzepnięcia w okresie wczesnego dzieciństwa. W zależności od miana inhibitora chorych dzieli się na 2 grupy: na silnie i słabo reagujących na antygen (high responders i low responders). Jeśli miano inhibitora przekracza 5 jednostek Bethesda, to określa się go jako silny (o wysokim mianie), jeśli miano inhibitora jest zawsze ≤5 jednostek Bethesda, to określany jest jako inhibitor słaby (o niskim mianie). Im wyższe jest miano inhibitora, tym szybciej inaktywowany jest czynnik krzepnięcia. Wystąpienie inhibitora u chorego na ciężką hemofilię nie wpływa na zwiększenie częstotliwości krwawień, ale uniemożliwia skuteczne leczenie i prowadzi do znacznego pogorszenia jakości życia. Inhibitor do czynnika IX wiąże się ze skłonnością do reakcji alergicznych, które występują u około połowy pacjentów i mogą występować pod postacią reakcji anafilaktycznej zagrażającej życiu. Stąd bardzo istotne jest, aby pierwsze podania czynnika IX u chorych były zawsze wykonywane w warunkach szpitalnych. O pojawieniu się inhibitora w umiarkowanej i łagodnej hemofilii mogą świadczyć samoistne wylewy krwi, które z reguły w tych postaciach choroby nie występują. Leczenie chorych z inhibitorem ma dwa cele, czyli trwałą eliminację inhibitora oraz zapobieganie i hamowanie krwawień. Trwałą eliminację inhibitora udaje się osiągnąć u części chorych poprzez wytworzenie stanu immunotolerancji wobec niedoborowego czynnika krzepnięcia. Nie ma jednej skutecznej i niezawodnej metody na przeprowadzenie ITI (wywoływanie tolerancji immunologicznej); każdy ośrodek dobiera leczenie dla swojego pacjenta oparte na doświadczeniach, zależne od zasobów finansowych etc. W Polsce najczęściej stosuje się metodę dużych dawek czynnika krzepnięcia 100-200 j./kg na dobę. Jest to terapia długotrwała, wymagająca dostępu do żył centralnych i bardzo obciążająca, prowadzi się ją nawet do 36 miesięcy. Należy pamiętać, że inhibitor powstaje najczęściej we wczesnym dzieciństwie, a leczenie spoczywa na rodzicach dziecka i odbywa się w warunkach domowych. Szansa na uzyskanie immunotolerancji w ciężkiej hemofilii A wynosi od 70 nawet do 90%. ITI u chorych z hemofilią B jest bardzo problematyczne z uwagi na często występujące ciężkie objawy alergiczne, w tym reakcje anafilaktyczne, które mogą uniemożliwić leczenie pacjenta. Ponadto w hemofilii B w trakcie immunotolerancji często dochodzi do powikłania, jakim jest zespół nerczycowy, który w części przypadków nie ustępuje samoistnie i wymaga przewlekłego leczenia immunosupresyjnego. Leczenie krwawień u chorych z hemofilią powikłaną inhibitorem często stanowi duże wyzwanie. W zależności od sytuacji klinicznej w profilaktyce i leczeniu chorych stosuje się koncentraty czynnika VIII w zwiększonych dawkach, koncentraty aktywowanych czynników zespołu protrombiny (aPCC) i rekombinowany aktywowany czynnik VII (rVIIa), a lekami wspomagającymi są leki antyfibrynolityczne (w Polsce najczęściej stosowany jest kwas traneksamowy). Zabiegi operacyjne u chorych z inhibitorem obarczone są bardzo wysokim ryzykiem krwawienia. Jeśli pacjent bezwzględnie wymaga przeprowadzenia zabiegu, to może być on wykonany w ośrodku referencyjnym, mającym doświadczenie w leczeniu takich chorych. Jeśli u pacjenta nie uda się wywołać immunotolerancji (nieskuteczna ITI), to w Polsce od kilku lat taki pacjent może mieć prowadzoną profilaktykę z zastosowaniem Emicizumabu (przeciwciało monoklonalne zastępujące funkcję czynnika VIII, podawane podskórnie). Jest to leczenie finansowane przez Ministra Zdrowia w ramach modułu „Narodowego Programu Leczenia Hemofilii i Pokrewnych Skaz Krwotocznych na lata 2019-2023” i wymaga uzyskania zgody formalnej, która wydawana jest przez Radę Programu. Do opracowania materiału wykorzystano: Część I: Wytyczne postępowania w hemofilii A i B niepowikłanej inhibitorem czynnika (VIII i IX), wydanie zaktualizowane – 2016 r. (Jerzy Windyga, Krzysztof Chojnowski, Anna Klukowska, Magdalena Łętowska, Andrzej Mital, Jacek Musiał, Jarosław Peregud-Pogorzelski, Maria Podolak-Dawidziak, Jacek Treliński, Anetta Undas, Tomasz Urasiński, Joanna Zdziarska, Krystyna Zawilska) Część II: Wytyczne postępowania w hemofilii A i B niepowikłanej inhibitorem czynnika (VIII i IX), 2 wydanie – 2017 r. (Jerzy Windyga, Krzysztof Chojnowski, Anna Klukowska, Magdalena Łętowska, Andrzej Mital, Wojciech Młynarski, Jacek Musiał, Jarosław Peregud-Pogorzelski, Maria Podolak-Dawidziak, Jacek Treliński, Anetta Undas, Tomasz Urasiński, Joanna Zdziarska, Krystyna Zawilska)


